新版《藥品技術轉讓注冊管理規定》解讀 聚焦技術服務的機遇與挑戰
藥品技術轉讓是醫藥產業資源優化配置、推動創新成果轉化的重要環節。國家藥品監督管理局發布了修訂后的《藥品技術轉讓注冊管理規定》(以下簡稱“新版規定”),對藥品生產技術的轉讓、注冊及相關技術服務活動提出了更明確、更系統化的要求。新規的出臺,旨在進一步規范市場秩序,保障藥品安全、有效和質量可控,同時也為專業的藥品研發與生產技術服務機構(CRO/CDMO等)帶來了新的發展機遇與合規挑戰。
一、 核心變化:強化全過程監管與主體責任
新版規定相較于以往,最顯著的特點是強化了對技術轉讓全過程的監管,并進一步明確了轉讓方、受讓方以及相關技術服務提供方的責任。
- 技術評估要求提升:新規強調,技術轉讓必須基于充分的研究驗證和數據支持。轉讓方需提供完整的技術資料,證明其技術的成熟度、穩定性以及轉移到新生產場地后的可重現性。這不僅涉及生產工藝,還包括質量控制方法、穩定性研究等關鍵環節。這對提供工藝驗證、分析方法轉移等技術服務的機構提出了更高的專業能力要求。
- “技術服務”角色凸顯:在技術轉讓過程中,第三方技術服務的作用被更加重視。無論是協助進行工藝放大、清潔驗證、分析方法轉移,還是提供符合法規要求的申報資料撰寫服務,專業的技術服務已成為確保轉讓成功的關鍵支撐。新規要求,這些技術服務活動及其提供方也需納入質量體系管理,其資質、能力和記錄將受到更嚴格的審視。
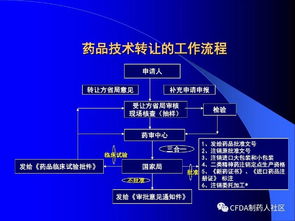
- 注冊程序優化與風險管控:新版規定對技術轉讓的注冊申報路徑進行了梳理,明確了不同情形下的資料要求。強化了基于風險的審評原則,對于生產工藝發生重大變更的轉讓,可能需要提交更充分的對比研究數據甚至進行臨床試驗。這要求技術服務方必須具備深厚的法規知識和風險評估能力,能夠為委托方設計科學合理的轉移與研究方案。
二、 對技術服務提供方的影響與應對策略
新版規定為專業的技術服務機構創造了更廣闊的市場需求,但也設立了更高的準入門檻。
- 機遇方面:
- 需求專業化:藥企對高效、合規完成技術轉讓的需求激增,更傾向于委托具有豐富經驗和完整質量體系的專業服務機構。
- 服務鏈條延伸:技術服務不再局限于單個環節,而是向提供從技術評估、方案設計、實施驗證到注冊申報支持的“一站式”解決方案發展。
- 價值認可提升:規范、可靠的技術服務成為保障藥品質量和上市速度的核心要素,其價值在產業鏈中得到進一步認可。
- 挑戰與應對:
- 合規能力建設:服務機構必須深入理解新版規定及相關的GMP、GCP等規范,建立完善的質量管理體系,確保服務全過程可追溯、數據真實可靠。
- 技術能力升級:需要持續投入,增強在工藝開發、分析技術、規模化生產等方面的硬實力,以應對復雜技術的轉移挑戰。
- 人才團隊培養:亟需培養既懂技術又懂法規的復合型人才,能夠精準理解客戶需求并提供符合監管要求的解決方案。
三、 展望:推動行業高質量發展
新版《藥品技術轉讓注冊管理規定》的實施,標志著我國藥品技術轉移管理進入了更加科學、嚴謹的新階段。它通過抬高合規與技術門檻,旨在淘汰不規范的操作,鼓勵真正有實力、負責任的企業和技術服務機構發展。長遠來看,這將有助于優化醫藥產業創新生態,促進優質技術資源的高效流動,推動我國從制藥大國向制藥強國邁進。
對于所有市場參與者而言,唯有主動適應新規,夯實自身的技術與服務能力,才能在以“技術”和“質量”為核心競爭力的新格局中贏得先機。
如若轉載,請注明出處:http://m.bed1688.cn/product/30.html
更新時間:2026-01-07 11:39:18